В ходе эволюции живые существа выработали целый ряд механизмов для повышения устойчивости к различным помехам, в том числе — к постоянно возникающим случайным мутациям. К таким механизмам можно отнести регуляторные контуры с отрицательными обратными связями, белки-шапероны, помогающие мутантным белкам принять правильную трехмерную конфигурацию (см.:Когда вредных мутаций много, они не так вредны, «Элементы», 06.12.2005), дублирование функций белок-кодирующих и регуляторных последовательностей, что порождает кажущуюся «генетическую избыточность» (см.: Устойчивое развитие конечностей у мышей обеспечивается дублированием регуляторов, «Элементы», 06.02.2018).
Еще один механизм, помогающий сгладить последствия потенциально вредных мутаций, называют нонсенс-опосредованным распадом мРНК (NMD, nonsense-mediated decay). Если в каком-то гене в результате мутации возникает преждевременный стоп-кодон (такие мутации называют нонсенс-мутациями), то считанная с такого гена матричная РНК уничтожается: ее разрезают на кусочки белки системы NMD. Это позволяет избежать синтеза бессмысленных «усеченных» белков, потенциально вредных для клетки и организма.
Как выяснилось, у системы NMD есть хитроумная надстройка, помогающая дополнительно снизить вредоносность нонсенс-мутаций. Сразу двум исследовательским коллективам из Германии и Китая удалось в общих чертах расшифровать принцип работы этого механизма, о чем рассказывается в двух статьях, опубликованных в свежем номере журнала Nature.
Обе группы пытались понять причины странного явления, которое состоит в следующем. Иногда подавление экспрессии («нокдаун») какого-нибудь гена приводит к серьезному изменению фенотипа. Но если тот же самый ген «нокаутировать» путем внесения в него нонсенс-мутации, то фенотип получается нормальный. Такое удивительное расхождение между результатами генетического нокдауна и нокаута было показано для многих генов у классических модельных объектов: мыши, рыбки данио-рерио и растения резуховидки Таля.
Недавно выяснилось, что в ответ на нокаут (но не нокдаун!) некоторых генов происходит усиление экспрессии генов, родственных нокаутированному, то есть имеющих похожую нуклеотидную последовательность. Обычно это паралоги — потомки одного и того же предкового гена, некогда возникшие в результате генных дупликаций, поделившие между собой функции и успевшие накопить нуклеотидные различия. В результате в клетках синтезируются дополнительные молекулы белков, похожих по своей аминокислотной последовательности на тот белок, чей ген был испорчен мутацией. По-видимому, эти белки частично берут на себя его функцию, тем самым помогая сгладить негативные последствия нонсенс-мутации. Явление назвали «генетическим компенсаторным ответом» (genetic compensation response, GCR; см. A. Rossi et al., 2015. Genetic compensation induced by deleterious mutations but not gene knockdowns).
Но каким образом нонсенс-мутация в одном гене приводит к активации экспрессии других генов, родственных нокаутированному? До сих пор ответа на этот вопрос не было.
Оба исследовательских коллектива работали с рыбками данио-рерио, а один из них (M. A. El-Brolosy et al.) — также с культурами мышиных клеток. Чтобы найти связующие звенья между нокаутом гена и активацией экспрессии родственных генов, обе группы провели множество экспериментов с широким кругом генов и мутаций, вызывающих (или не вызывающих) генетический компенсаторный ответ (GCR). Результаты, полученные на многих разных генах (и рыбьих, и мышиных), оказались схожими.
В частности, китайский коллектив работал с геном capn3a. Если у эмбрионов данио-рерио заблокировать транскрипцию или трансляцию этого гена, не меняя сам ген, то есть осуществить нокдаун, то получаются рыбки с недоразвитой печенью. Однако печень нормально развивается у нокаутных рыбок capn3aΔ14/Δ14, у которых из первого экзона гена capn3a вырезан кусок длиной в 14 нуклеотидов, что приводит к появлению преждевременного стоп-кодона. Оказалось, что у нокаутных эмбрионов резко повышен (по сравнению и с «нокдаунными», и с обычными, контрольными эмбрионами) уровень экспрессии нескольких генов, родственных испорченному, в том числе capn8 и capn12. Дополнительные эксперименты подтвердили, что это типичный пример GCR. Именно наличие нонсенс-мутации в гене capn3a, при обязательном условии присутствия считанных с мутантного гена матричных РНК, но не само по себе отсутствие функционального белка Capn3a (которого нет ни у нокаутных, ни у нокдаунных рыбок), стимулирует экспрессию родственных генов capn8 и capn12. Повышенная активность родственных генов сводит на нет негативные последствия нонсенс-мутации.
Установив эти факты, исследователи стали экспериментировать с другими мутациями гена capn3a. Оказалось, что GCR наблюдается только в тех случаях, когда мутация приводит к появлению преждевременного стоп-кодона в любом экзоне, кроме последнего. Это наводит на мысль об участии механизма NMD, потому что нонсенс-опосредованный распад мРНК включается как раз при наличии преждевременного стоп-кодона в любом экзоне, кроме последнего. Механизм NMD срабатывает, когда рибосома, осуществляющая трансляцию мРНК, прекращает свою работу на стоп-кодоне, не дойдя до группы белков, которые в ходе сплайсинга прикрепляются к мРНК в местах сращивания экзонов.
Аналогичные результаты дали и эксперименты с другими генами, в том числе с геном nid1a, нокдаун которого ведет к уменьшению длины тела данио-рерио, а нонсенс-мутации дают нормальный фенотип благодаря GCR (потому что повышается экспрессия родственных генов nid1b и nid2a).
Гипотеза об участии системы NMD в генетическом компенсаторном ответе была подтверждена дальнейшими экспериментами. В частности, оказалось, что GCR сходит на нет, если подавить экспрессию некоторых генов, участвующих в NMD — в особенности гена upf3a. Результаты по еще одному вовлеченному в NMD гену, upf1, у двух исследовательских групп получились разные: то ли этот ген важен для GCR (M. A. El-Brolosy et al.), то ли не очень (Z. Ma et al.).
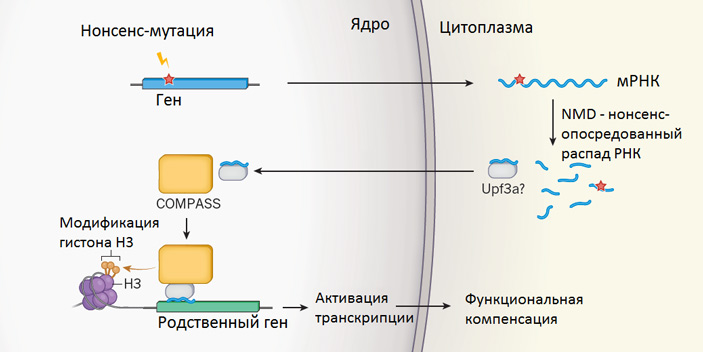
Так или иначе, upf3a, по-видимому, является одним из главных связующих звеньев между нонсенс-мутациями и компенсаторным повышением экспрессии родственных генов. Ранее уже было замечено, что при GCR в промоторных областях генов, экспрессия которых повышается в ответ на нонсенс-мутацию родственного гена, растет частота встречаемости эпигенетической метки, которая называется H3K4me3 (триметилирование лизина, занимающего четвертую позицию в гистоне Н3). Эти метки, собственно, и являются причиной усиленной экспрессии упомянутых генов. Новые эксперименты подтвердили эти факты. Кроме того, они показали, что для появления дополнительных меток H3K4me3 в промоторных областях «компенсирующих» генов (но не в других частях генома) необходима нормальная работа гена upf3a. Если этот ген отключить, то GCR не происходит, по-видимому, именно по той причине, что в промоторных областях «компенсирующих» генов не образуются метки H3K4me3.
За формирование меток H3K4me3 в промоторных областях генов отвечает белковый комплекс COMPASS. Дополнительные эксперименты показали, что белок Upf3a избирательно связывается с белком Wdr5, входящим в состав комплекса COMPASS, и что этот комплекс действительно прикрепляется к промоторным участкам «компенсирующих» генов при GCR. Кроме того, в нескольких экспериментах было показано, что без нормально работающего белка Wdr5 генетический компенсаторный ответ не происходит. Например, у мутантных эмбрионов capn3aΔ14/Δ14, у которых вдобавок был выведен из строя ген wdr5, печень вообще не сформировалась, а экспрессия capn8 и capn12 не повысилась.
Полученные результаты в целом согласуются со схемой, показанной на рисунке. Некоторые детали этой схемы уже можно считать доказанными, в то время как другие нуждаются в дополнительных подтверждениях. К числу надежно установленных фактов можно отнести участие в GCR нонсенс-опосредованного распада мРНК, белка Upf3a, белкового комплекса COMPASS и эпигенетических меток H3K4me3 в промоторных областях «компенсирующих» генов, а также взаимодействие Upf3a c COMPASS. Идея о том, что обрезки разрушенной мРНК прикрепляются к белку Upf3a и используются им для обнаружения генов с похожей последовательностью (подобно «гидовым» РНК в системе CRISPR) и для привлечения к этим генам комплекса COMPASS, на данный момент является красивой и правдоподобной, но не доказанной гипотезой.
Полученные результаты важны как в теоретическом, так и в практическом плане. С одной стороны, они показывают, насколько неполны до сих пор наши знания и о регуляции экспрессии генов, и о механизмах устойчивости к мутациям. Кроме того, они объясняют, почему разные способы отключения одних и тех же генов могут давать разные результаты на уровне фенотипа. Это важно учитывать при планировании молекулярно-генетических экспериментов. Например, если мы хотим нокаутировать ген, чтобы выяснить его функцию, то нужно позаботиться о том, чтобы не сработал нонсенс-опосредованный компенсаторный ответ. Ведь иначе можно принять важный ген за «функционально избыточный» только потому, что эволюция сумела создать компенсаторный механизм, позволяющий справляться с некоторыми (но не любыми) его поломками. Наконец, исследование заставляет по-новому взглянуть на эволюционную роль генных дупликаций, благодаря которым в геномах эукариот присутствует так много семейств родственных генов (паралогов). Даже если паралоги давно поделили между собой функции и в норме работают в разных тканях и на разных стадиях развития, они, как выясняется, при необходимости могут привлекаться для «затыкания дырок» в других молекулярных системах, поврежденных мутациями, тем самым повышая помехоустойчивость организма.
Источник: elementy.ru