Сейчас на Земле живет более 7,7 миллиардов человек, каждый из которых особенный — отличается от остальных и внешне, и на уровне ДНК. Если взять пару случайно выбранных человек (не родственников) и сравнить их генетические последовательности, то в среднем на тысячу нуклеотидов будет приходиться одно различие, а на весь геном — около 6 млн различающихся нуклеотидов. Всё это разнообразие генетических вариантов — результат множества мутаций, которые происходили в прошлом и продолжают происходить сейчас. Каждый ребенок получает несколько десятков новых мутаций, которые отличают его ДНК от ДНК обоих родителей. Мы не слишком много знаем о том, как, когда и почему возникают эти мутации, от чего именно зависит их число и расположение в геноме. А между тем, ответы на эти вопросы важны и с точки зрения ожидаемого вреда от de novo мутаций — для каждого индивида и для человеческой популяции в целом (особенно в свете рассуждений о все более ослабленном отборе благодаря развитию медицины), — и с точки зрения понимания человеческой эволюции, ведь именно мутации представляют тот материал, на основе которого естественный отбор творит новые признаки и адаптации. К тому же, точные сведения по частоте мутаций нужны для калибровки так называемых «молекулярных часов», при помощи которых эволюционные биологи вычисляют время расхождения наших предковых линий.
Мутации все же происходят достаточно редко, и для получения надежных статистических выводов об их частоте и о закономерностях их распределения в геноме длиной больше 6 миллиардов «букв» (которых каждый ребенок получает примерно по 3,1 млрд от папы и от мамы) нужны данные по большому числу людей. В наше время невероятного удешевления секвенирования и финансирования государствами обширных программ, в которых задействованы десятки и сотни тысяч людей, ученые получают возможность давать все более качественные оценки, касающиеся самых разнообразных процессов в генетическом материале, в частности, — мутаций и рекомбинаций.
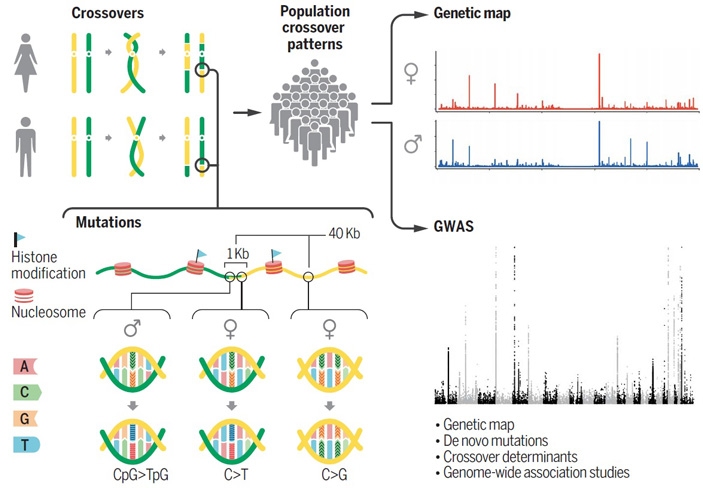
Работа, опубликованная в журнале Science, была проведена на данных полногеномного секвенирования жителей Исландии (в этой стране и выполнено исследование). Для выявления событий мутации и рекомбинации анализировали тройки, состоящие из матери, отца и ребенка. Исследование охватило несколько десятков тысяч семей, на которые в сумме пришлось 70 086 проанализированных материнских и 56 321 отцовских мейозов. Такое число мейозов соответствовало 3 055 395 событий кроссинговера в материнских гаметах и 1 476 140 кроссинговеров в отцовских. Поделив, получим примерно 43,6 кроссинговера на каждую материнскую гамету и 26 — на каждую отцовскую. Учитывая, что в гамете содержится 23 хромосомы, эти цифры говорят о том, что в хромосомах матери, в отличие от отцовских, как правило, случается более одного события кроссинговера. К тому же выяснилось, что с возрастом матери количество кроссинговеров в ее хромосомах увеличивается (примерно на одно дополнительное событие за каждые 10 лет, рис. 2).
Применение самых современных технологий и алгоритмов позволило определить локализацию точек рекомбинации с беспрецедентным разрешением (655–708 нуклеотидов — этот результат в два раза выше, чем в самых лучших из более ранних публикаций). 70–75% событий попадали в ранее детектированные горячие области рекомбинации — так называют те участки, в которых вероятность рекомбинации в 10 раз выше, чем в среднем по геному. Суммарная длина этих областей составляет 1,6–1,8% от всего генома.
Для анализа локализации de novo мутаций было исследовано 2976 троек «мать, отец, ребенок». Всего обнаружилось 200 435 мутаций (в среднем около 67 мутаций на ребенка), для части из которых было определено, от кого из родителей она досталась ребенку: 62 546 мутаций на хромосомах было от отцов, 17 139 мутаций на хромосомах — от матерей. Более высокая частота возникновения мутаций в мужских гаметах согласуется и с ранее известными данными. Авторы также обращают внимание, что количество возникающих мутаций возрастало по мере увеличения возраста обоих родителей, хотя и неодинаково: каждый год жизни отца по расчетам увеличивает число мутаций в среднем на 1,39, а матери — на 0,38. Большинство мутаций (128 278 из 200 435) были транзициями (заменами пуринового основания на пуриновое или пиримидинового на пиримидиновое), гораздо меньше (58 289) было трансверсий (замен пуринового основания на пиримидиновое или наоборот) и небольших инсерций/делеций (13 868).
Центральной задачей работы был анализ связи между рекомбинацией и возникающими мутациями. Эта связь теоретически ожидаема, поскольку необходимым этапом при рекомбинации являются вносимые специальными ферментами двуцепочечные разрывы хромосом, которые в последующем восстанавливаются при помощи белков системы репарации. Именно на этапе репарации могут возникать «ошибки», приводящие к появлению мутаций. В хромосомах, полученных ребенком от отца, число мутаций в пределах 1000 нуклеотидов расстояния от точки рекомбинации оказалось в 41,5 раза выше, чем в среднем по геному, в хромосомах, полученных от матери — в 58,4 раза (рис. 3). В общем, на область ближайшей тысячи нуклеотидов от точки рекомбинации пришлось около половины всех обнаруженных de novo мутаций.
Попутно авторы проверили наличие взаимосвязи между частотой рекомбинационных событий и сайтами полиморфизма, в результате чего вычислили 20 генов, влияющих на данный процесс, 12 из которых отмечены впервые. В их число вошли гены белков, отвечающих за конъюгацию хромосом в мейозе, за узнавание и эпигенетическую разметку горячих сайтов рекомбинации (в частности, белок PRDM9, о котором на «Элементах» уже рассказывали, см. новость «Ген видообразования» не позволяет хромосомам рваться в неположенных местах, «Элементы», 18.06.2012), за раскручивание и разрезание нити ДНК, за передачу сигналов о повреждениях ДНК, а также за ее репарацию.
Важно отметить, что рекомбинация осуществляется в областях с особым комплексом эпигенетических маркеров на хроматине, и это делает процесс управляемым: события кроссинговера практически никогда не происходят в области работающих генов. А значит, и возникающие мутации преимущественно располагаются за пределами генов, где они могли бы оказать заметный негативный эффект.
Работа, опубликованная в журнале Nature Ecology & Evolution, которая была проведена учеными из Дании, нацелена на то, чтобы сопоставить частоту возникновения мутаций de novo у человека и человекообразных обезьян — шимпанзе, гориллы и орангутана. Как и для людей, было проведено полногеномное секвенирование в тройках «мама, папа, детеныш», для некоторых животных — в двух поколениях (рис. 4). Оказалось, что (как и у людей) возраст обезьян-отцов прибавлял количество мутаций у детеныша, но эта скорость оказалась в среднем в 1,5 раза выше, чем у мужчин того же возраста. Выстроив математическую модель, авторы показали, что выявленное замедление вероятно началось совсем недавно (по эволюционным меркам) — примерно 400 тысяч лет назад. Причины не ясны (авторы пускаются здесь в туманные рассуждения о, возможно, более благоприятных условиях жизни или влияния сдвига начала полового созревания на более поздний срок), но важен сам факт: рассчитывая время разделения линий человека с другими человекообразными, нужно делать корректировку именно по обезьянам.
Это соображение авторы применили к тем данным, на основе которых описывают историю обособления наших линий: с одной стороны, молекулярные данные и метод молекулярных часов, а с другой стороны — палеонтологический материал. И вот тут оказывается, что если молекулярные часы настраивать по человеку, то время разделения нашей линии с линиями шимпанзе, гориллы и орангутана выпадает на сроки, соответственно, 15, 19 и 35 млн лет назад, а если по человекообразным обезьянам, — то 10, 15 и 23 млн лет назад. И вот эти последние цифры гораздо лучше согласуются с палеонтологическими ископаемыми, чем первые (рис. 5). Корректировка оценки частот мутаций также может оказаться существенной и определения времени разделения сапиенсов с неандертальцами и денисовцами: ведь не исключено, что изменение частоты мутаций произошло уже после разделения и только в линии Homo sapiens, или изменялось в разных линиях Homo по-разному.
Надо сказать, эта работа оставляет ощущение недосказанности: во-первых, хотелось бы, чтобы данные были собраны для большего числа животных, а во-вторых, любопытно все-таки узнать, что же могло привести к снижению частоты мутаций у людей, если оно действительно имеет место. Если провести логическую нить между первым и вторым исследованием, можно было бы, пожалуй, для начала проверить, не различается ли между человеком и остальными человекообразными частота рекомбинации при кроссинговере. Наверняка эти вопросы уже на очереди у авторов этих исследований и продолжение не заставит себя долго ждать.
1) Bjarni V. Halldorsson, Gunnar Palsson, Olafur A. Stefansson, Hakon Jonsson, Marteinn T. Hardarson, Hannes P. Eggertsson, Bjarni Gunnarsson, Asmundur Oddsson, Gisli H. Halldorsson, Florian Zink, Sigurjon A. Gudjonsson, Michael L. Frigge, Gudmar Thorleifsson, Asgeir Sigurdsson, Simon N. Stacey, Patrick Sulem, Gisli Masson, Agnar Helgason, Daniel F. Gudbjartsson, Unnur Thorsteinsdottir, Kari Stefansson. Characterizing mutagenic effects of recombination through a sequence-level genetic map // Science. 2019. V. 363. eaau1043. DOI: 10.1126/science.aau1043.
2) Søren Besenbacher, Christina Hvilsom, Tomas Marques-Bonet, Thomas Mailund & Mikkel Heide Schierup. Direct estimation of mutations in great apes reconciles phylogenetic dating // Nature Ecology & Evolution. 2019. DOI: 10.1038/s41559-018-0778-x.
Источник: https://elementy.ru/